遗传性耳聋
生物课题:\(\mathrm{Otof}\) 突变导致的遗传性耳聋
症状1
- 重度至极重度双侧耳聋,言语辨别能力较差
- 存在耳声发射,但可能会随年龄的增长而减少或消失
当声音刺激进入内耳时,听觉器官中的毛细胞会产生声音响应,这些声音被称为耳声发射。这些声音是由毛细胞的振动引起的。
- 听觉脑干反应异常
听觉刺激传入耳朵并通过听觉神经传递至大脑干时,会产生一系列特定的电活动,这些活动可以通过电极放置在头皮上来进行记录。
- 一些突变会导致温度敏感性听觉紊乱。体温升高会导致重度至极重度听力损失,而正常体温会导致正常至中度听力。但对温度敏感的听力损失的机制基本上仍然未知。
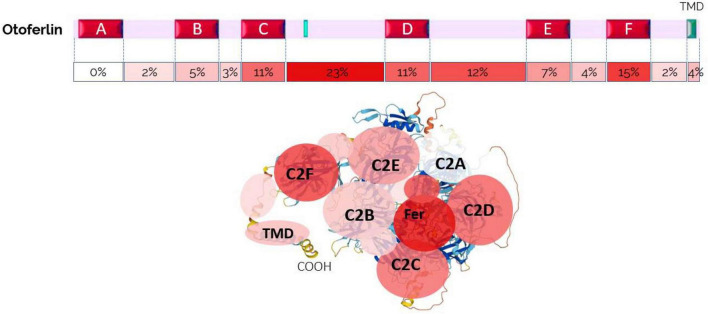
(#基因突变)都位于 \(\mathrm{C2C}\) 到 \(\mathrm{C2F}\) 结构域之间。
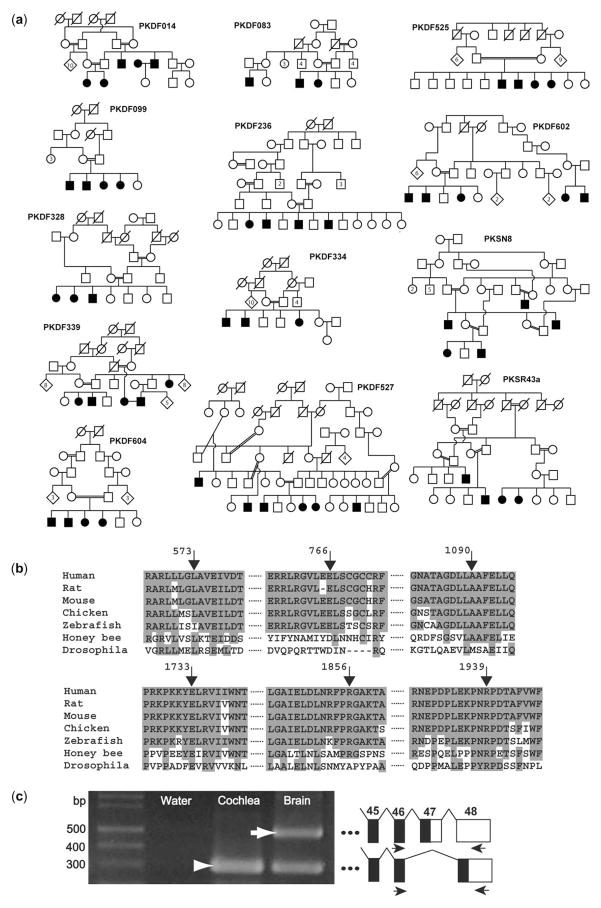
遗传规律
查询数据库可知,\(\mathrm{Otof}\) 突变导致的遗传性耳聋是常染色体隐性遗传,致病基因 \(\mathrm{Otof}\) 位于 \(2\) 号染色体短臂 \(2\) 区 \(3\) 带第 \(3\) 亚带 \((\mathrm{2p23.3})\)2
发病率
患病率因种族而异,部分地区 \(1\% - 8\%\) 不等。平均每 \(1000\) 名新生儿中就有 \(1\) 名。
听觉神经病变谱系障碍 \((\mathrm{ANSD})\) 的个体中,\(\mathrm{Otof}\) 是一种常见的遗传原因,在 \(41\%-91\%\) 的测试者中发现。
病因4
\(\mathrm{Otof}\) 蛋白
\(\mathrm{Otoferlin}\) 是一种大的 \(1997\) 氨基酸蛋白,包括将蛋白质锚定到囊泡膜的单个 \(\mathrm{C}\) 端跨膜结构域 \(\mathrm{(TMD)}\) 和六个定向于 \(\mathrm{IHC}\) 胞质溶胶的 \(\mathrm{C2}\) 结构域 \(\mathrm{(A-F)}\)。
结构域是介于二级和三级结构之间的另一种结构层次,指蛋白质亚基结构中明显分开的紧密球状结构区域
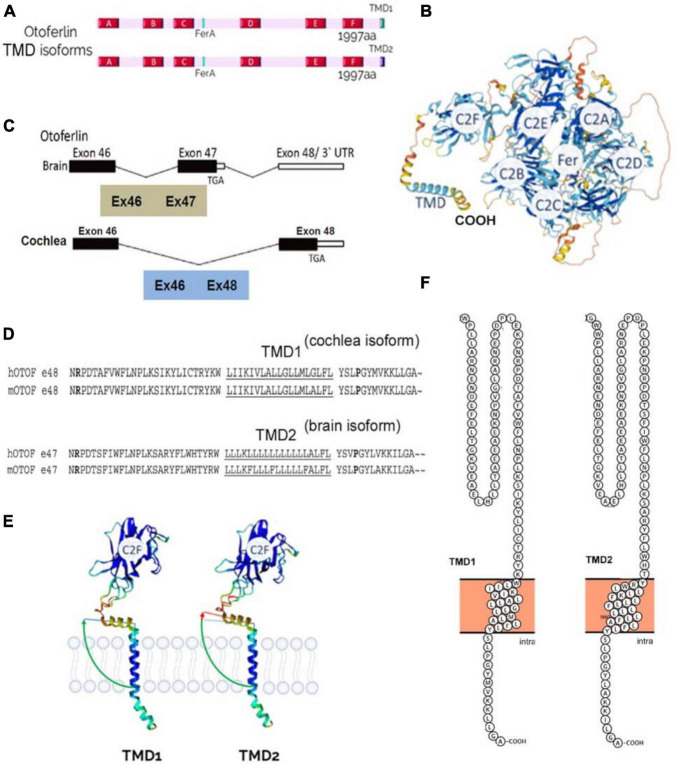
\(\mathrm{C2}\) 结构域由于存在五个天冬氨酸残基,构成 \(\mathrm{Ca^{2+}}\) 离子的假定结合位点。\(\mathrm{C2-A}\) 结构域是唯一预计由于顶部环较短而无法结合 \(\mathrm{Ca^{2+}}\) 的 \(\mathrm{C2}\) 结构域,因此缺乏天冬氨酸配位钙结合。
\(\mathrm{C2}\) 结构域的主要功能是在 \(\mathrm{Ca^{2+}}\) 结合后靶向膜表面。\(\mathrm{C2}\) 结构域通过使用疏水和静电相互作用的组合与靶膜结合,优先与磷脂酰肌醇 \(4,5-\) 二磷酸 \(\mathrm{PIP2}\) 或磷脂酰丝氨酸 \((\mathrm{PS})\)。\(\mathrm{Otoferlin}\) 还具有 \(\mathrm{FerA}\) 结构域,这是一个四螺旋束折叠,具有自己的\(\mathrm{Ca^{2+}}\) 依赖性磷脂结合活性,表明该结构域与膜的相互作用因 \(\mathrm{Ca^{2+}}\) 的存在而增强。
\(\mathrm{Otoferlin}\) 的功能和作用机制
现在已经确定,耳铁蛋白在 \(\mathrm{IHC}\) 中囊泡周期的几个基本阶段发挥作用,包括功能对接、启动、融合、内吞作用,以及囊泡的运输和成熟。
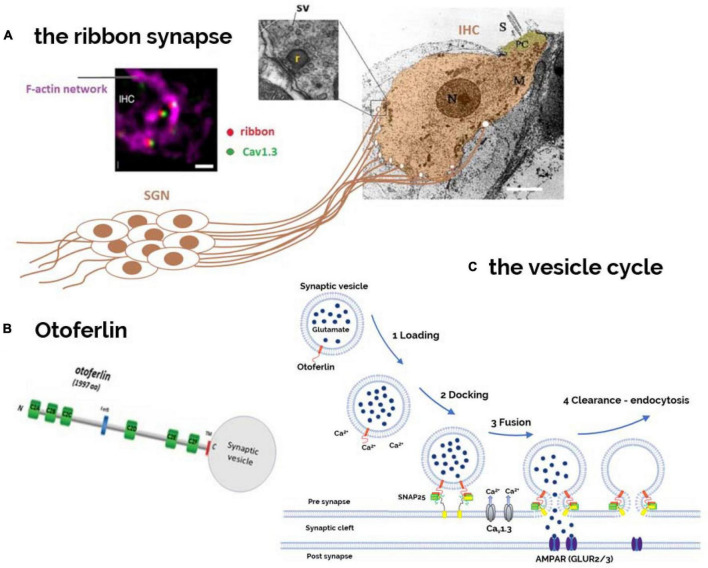
\(\mathrm{Otof}\) 蛋白参与 \(\mathrm{Ca^{2+}}\) 依赖的神经递质(谷氨酸)囊泡胞吐。\(\mathrm{IHC}\) 表面纤毛在淋巴液机械波的作用下摆动,使 \(\mathrm{IHC}\) 膜变形和胞内静水压力增大。
将 \(\mathrm{IHC}\) 建模为一种超弹性结构,类似于充气橡胶球囊中的压力变化。细胞内压力的变化可能是由于 \(\mathrm{Ca^{2+}}\) 诱导的耳铁蛋白的快速构象变化和/或快速、大量地添加到质膜上的囊泡膜引起的。
压强增大导致去极化 \(\mathrm{Ca^{2+}}\) 内流,促进含有谷氨酸的囊泡膜融合,释放神经递质,将物理信号转换为化学信号。膜融合使得 \(\mathrm{IHC}\) 表面积增加,促使细胞内压强回复正常,负反馈调节神经递质释放。
基因突变
蛋白质的所有其他区域都可能受到影响。根据人类基因突变数据库,\(41\%\) 的变异是错义的,\(22\%\) 是无义的,\(15\%\) 的缺失,\(14\%\) 的剪接,\(6\%\) 的插入,\(2\%\) 的拷贝数变异。
胚胎发育时 \(\mathrm{Otof}\) 缺失可能导致螺旋神经节神经元细胞凋亡,导致即使 \(\mathrm{Otof}\) 功能恢复也不能回到正常听力。
检测方法
- 耳声发射以及听觉脑干反应
- 多基因 \(\mathrm{panel}\) 或全面的基因组检测,而单基因检测很少有用,通常不推荐
- 检测语言发育迟缓
治疗方法
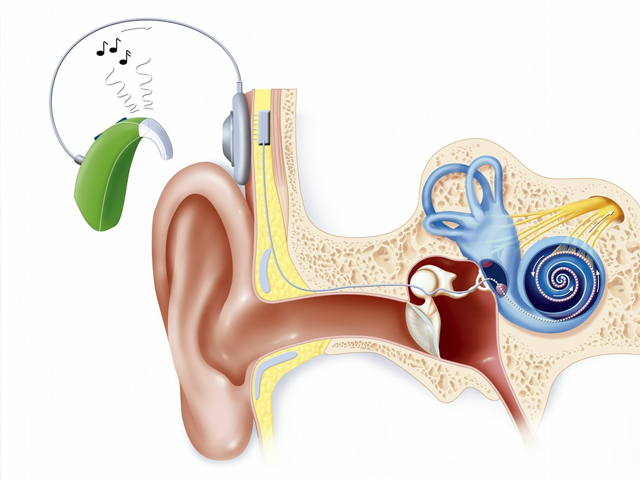
\(\mathrm{CI}\) 人工耳蜗植入
麦克风采集声音,言语处理器将采集到的声音加以数字化、处理和编码,传输线圈将编好的语码向体内发射,接收线圈接收语码,密闭刺激芯片将接收到的语码加以解码并转化为特殊电信号,根据进入声音的频率不同将电信号传导至蜗内相应的电极,蜗内电极刺激耳蜗相应的部位,听神经产生神经冲动并传到大脑听中枢产生听觉。
\(\mathrm{AAV-OTOF}\)5
腺相关病毒 \(\mathrm{(Adeno-associated virus,AAV)}\) 是目前发现结构最简单的、无包膜的单链 \(\mathrm{DNA}\) 病毒,病毒基因组长约有 \(4.7\mathrm{Kb}\),属于细小病毒家族。
感染宿主细胞后 \(\mathrm{AAV}\) 基因组以游离体的形式存在于细胞中,减少了治疗风险。
由于受到载体包装能力有限的限制,需要采用双 \(\mathrm{AAV}\) 方法,使用两种不同的重组载体,一种含有 \(5'\),另一种含有 \(3'\) 的 \(\mathrm{Otoferlin\space cDNA}\)。
\(\mathrm{cDNA}\) 特指在体外经过逆转录后与 \(\mathrm{RNA}\) 互补的 \(\mathrm{DNA}\) 链,与平常我们所称谓的基因组 \(\mathrm{DNA}\) 不同,\(\mathrm{cDNA}\) 没有内含子而只有外显子的序列。
将载体对单次递送至 \(\mathrm{Otof^{−/−}}\) 突变小鼠的成熟耳蜗中,通过重组 \(5'\) 和 \(3'\space \mathrm{cDNA}\) 重组,重组了 \(\mathrm{Otoferlin}\space(\mathrm{cDNA} ∼6 \mathrm{kb})\) 编码序列
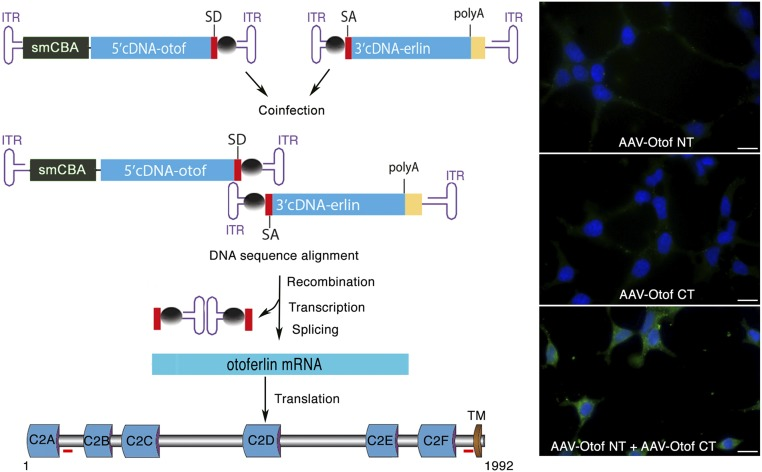
将小鼠耳铁蛋白 \(\mathrm{cDNA}\) 的编码序列拆分为 \(5'\) 片段 \((\mathrm{Otof\space NT}\),核苷酸 \(1-2,448)\) 和 \(3'\) 片段 \((\mathrm{Otof\space NT}\),核苷酸 \(2,449-5,979)\),每个片段都插入到携带重组桥接序列的 \(\mathrm{AAV}\) 载体中,实现了 \(\mathrm{Otof}\) 的基因递送与长时间表达。
未来与展望
- 为什么听觉和前庭毛细胞选择耳铁蛋白作为控制突触囊泡胞吐的关键 \(\mathrm{Ca^{2+}}\) 传感器,而不是在中央突触中发现的经典突触结合蛋白?
- 尽管耳铁蛋白在中枢神经系统中表达,特别是在皮层和杏仁核中,但它在脑组织中的作用仍然未知。
- 进一步研究铁蛋白在中枢神经系统中的作用的必要性,特别是它们可能参与神经退行性疾病,如阿尔茨海默病。
- \(1\) 月 \(25\) 日,复旦大学附属眼耳鼻喉科医院领衔在《柳叶刀》正刊发表了 6 名儿童接受 AAV1-hOTOF 基因治疗,五名儿童的听力恢复的文章。6
参考文献
Azaiez H, Thorpe RK, Smith RJH. OTOF-Related Deafness. 2008 Feb 29 [updated 2021 Jan 21]. In: Adam MP, Feldman J, Mirzaa GM, Pagon RA, Wallace SE, Bean LJH, Gripp KW, Amemiya A, editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993–2024. PMID: 20301429.↩︎
The UniProt Consortium , UniProt: the Universal Protein Knowledgebase in 2023, Nucleic Acids Research, Volume 51, Issue D1, 6 January 2023, Pages D523–D531,https://doi.org/10.1093/nar/gkac1052↩︎
Choi BY, Ahmed ZM, Riazuddin S, Bhinder MA, Shahzad M, Husnain T, Riazuddin S, Griffith AJ, Friedman TB. Identities and frequencies of mutations of the otoferlin gene (OTOF) causing DFNB9 deafness in Pakistan. Clin Genet. 2009 Mar;75(3):237-43. doi: 10.1111/j.1399-0004.2008.01128.x. PMID: 19250381; PMCID: PMC3461579.↩︎
Leclère JC, Dulon D. Otoferlin as a multirole Ca2+ signaling protein: from inner ear synapses to cancer pathways. Front Cell Neurosci. 2023 Jul 19;17:1197611. doi: 10.3389/fncel.2023.1197611. PMID: 37538852; PMCID: PMC10394277.↩︎
Akil O, Dyka F, Calvet C, Emptoz A, Lahlou G, Nouaille S, Boutet de Monvel J, Hardelin JP, Hauswirth WW, Avan P, Petit C, Safieddine S, Lustig LR. Dual AAV-mediated gene therapy restores hearing in a DFNB9 mouse model. Proc Natl Acad Sci U S A. 2019 Mar 5;116(10):4496-4501. doi: 10.1073/pnas.1817537116. Epub 2019 Feb 19. PMID: 30782832; PMCID: PMC6410774.↩︎
Lv J, Wang H, Cheng X, Chen Y, Wang D, Zhang L, Cao Q, Tang H, Hu S, Gao K, Xun M, Wang J, Wang Z, Zhu B, Cui C, Gao Z, Guo L, Yu S, Jiang L, Yin Y, Zhang J, Chen B, Wang W, Chai R, Chen ZY, Li H, Shu Y. AAV1-hOTOF gene therapy for autosomal recessive deafness 9: a single-arm trial. Lancet. 2024 Jan 24:S0140-6736(23)02874-X. doi: 10.1016/S0140-6736(23)02874-X. Epub ahead of print. PMID: 38280389.↩︎